Struktur Atom dan Sistem Periodik Unsur
Teori atom mengalami perkembangan seiring perkembangan ilmu pengetahuan.
Teori atom yang sudah dikenal, yaitu teori atom Dalton, Rutherford, Bohr, dan
mekanika kuantum. Teori atom ini digambarkan dengan model atom.
1. Teori
Atom Dalton
Menurut
Dalton, materi tersusun atas sejumlah partikel kecil yang tidak dapat dibagi
lagi disebut atom.
Model Atom Dalton:
a. Atom digambarkan sebagai bola pejal yang sangat kecil.
b. Atom merupakan partikel terkecil yang tidak dapat
dipecah lagi.
c. Atom suatu unsur sama memiliki sifat yang sama,
sedangkan atom unsur berbeda, berlainan dalam massa dan sifatnya.
d. Senyawa terbentuk jika atom bergabung satu sama lain.
e. Reaksi kimia hanyalah reorganisasi dari atom-atom,
sehingga tidak ada atom yang berubah akibat reaksi kimia.
2. Teori
Atom Thomson
Menurut teori atom Thomson, atom terdiri atas materi
bermuatan positif yang di dalamnya tersebar elektron seperti roti kismis.
Model Atom Thomson:
a) Setelah ditemukannya elektron oleh J.J Thomson,
disusunlah model atom Thomson
yang merupakan penyempurnaan dari model atom Dalton.
b) Atom terdiri dari materi bermuatan positif dan di
dalamnya tersebar elektron bagaikan kismis dalam roti kismis.
3. Teori Atom Rutherford
Menurut Rutherford,
sebagian besar atom terdiri atas ruang hampa. Massa atom bermuatan
positif dan terkonsentrasi pada bagian pusat atom yang disebut inti atom.
Model Atom Rutherford:
a) Rutherford menemukan bukti bahwa dalam atom terdapat
inti atom yang bermuatan positif, berukuran lebih kecil daripada ukuran atom
tetapi massa atom hampir seluruhnya berasal dari massa intinya.
b) Atom terdiri dari inti atom yang bermuatan positif dan
berada pada pusat atom serta elektron bergerak melintasi inti (seperti planet
dalam tata surya).
Kelemahan model Atom Rutherford:
a) Ketidakmampuan untuk menjelaskan mengapa elektron
tidak jatuh ke inti atom akibat gaya tarik elektrostatis inti terhadap
elektron.
b) Menurut teori Maxwell, jika elektron sebagai partikel
bermuatan mengitari inti yang memiliki muatan yang berlawanan maka lintasannya
akan berbentuk spiral dan akan kehilangan tenaga/energi dalam bentuk radiasi
sehingga akhirnya jatuh ke inti.
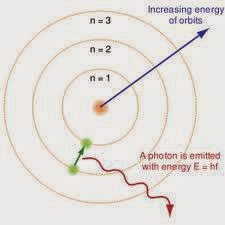
4. Teori Atom Bohr
Menurut
postulat Bohr, elektron mengelilingi inti atom pada orbit (lintasan) tertentu.
Selama berada dalam lintasannya, energi elektron tetap sehingga tidak ada
energi yang diserap dan dipancarkan.
Model Atom Bohr:
a) Model atomnya didasarkan pada teori kuantum untuk
menjelaskan spektrum gas hidrogen.
b) Menurut Bohr, spektrum garis menunjukkan bahwa elektron
hanya menempati tingkat-tingkat energi tertentu dalam atom.
5. Teori Atom Modern
Teori ini
menyatakan bahwa atom terdiri atas partikel-partikel kecil (partikel subatom)
yang disebut proton, elektron, dan neutron. Proton dan neutron terdapat dalam
inti atom, sedangkan elektron mengisi ruang di sekitar inti.
Sistem
Periodik Unsur (SPU)
Sistem
periodik unsur adalah suatu daftar unsur-unsur yang disusun dengan aturan
tertentu. Semua unsur yang sudah dikenal ada dalam daftar tersebut.
1. Perkembangan Dasar Pengelompokan Unsur
a. Pengelompokan atas Logam dan NonLogam
Unsur-unsur
yang ada di alam dikelompokkan ke dalam 2 kelompok yaitu logam dan non logam. Pengelompokan ini merupakan metode
paling sederhana, dilakukan
dengan cara mengamati ciri-ciri fisiknya.
b. Triade Dobereiner
Pada tahun 1829, Johan Wolfgang Dobereiner ,seorang
profesor kimia di Jerman, mengemukakan bahwa massa atom relatif stronsium
sangat dekat dengan massa rata-rata dari dua unsur lain yang mirip stronsium,
yaitu kalsium dan barium. Dobereiner juga menemukan beberapa kelompok unsur
lain mempunyai gejala seperti itu. Oleh karena itu, Dobereiner mengambilan
kesimpulan bahwa unsur-unsur dapat dikelompokan ke dalam kelompok-kelompok tiga
unsur yang disbutnya triade. Namun sayang, Dobereiner tidak berhasil
menunjukkan cukup banyak triade sehingga aturan tersebut tidak bermanfaat.
c. Hukum
Oktaf Newlands
J.W. Newlands merupakan orang yang mengelompokkan
unsur berdasarkan kenaikan massa atom relatif. Pada tahun 1863, ia menyatakan
bahwa sifat sifat unsur berubah secara teratur. Unsur pertama mirip dengan
unsur kedelapan, unsur kedua mirip dengan unsur kesembilan dan seterusnya.
d. Sistem Periodik
Mendeleev
Diantara para ahli yang dianggap paling berhasil dalam
mengelompokkan unsur-unsur dan berani menduga adanya unsur-unsur yang pada saat
itu belum ditemukan adalah Dmitry
Mendeleev. Mendeleev mengelompokkan unsur berdasarkan kenaikan massa
atom relatifnya. Cara pengelompokkan dilakukan dengan menggunakan kartu. Dalam
kartu tersebut ditulis lambang atom, massa atom relatifnya dan sifat-sifatnya.
Mendeleev selanjutnya menempatkan unsur-unsur dengan kemiripan sifat pada satu
lajur vertikal yang disebut golongan. Unsur-unsur juga disusun berdasarkan
kenaikan massa atom relatifnya dan ditempatkan dalam satu lajur yang disebut
periode. Sistem periodik yang disusun Mendeleev dapat dilihat pada tabel
berikut:
Mendeleev sengaja mengosongkan beberapa tempat untuk
menetapkan kemiripan sifat dalam golongan. Beberapa kotak juga sengaja
dikosongkan karena Mendeleev yakin masih ada unsur yang belum dikenal karena
belum ditemukan. Salah satu unsur baru yang sesuai dengan ramalan Mendeleev
adalah germanium yang sebelumnya diberi nama ekasilikon oleh Mendeleev.
e. Sistem
Periodik Modern dari Hhenry G. Moseley
Pada awal abad 20, setelah penemuan nomor atom, Henry
Moseley menunjukkan bahwa urut-urutan unsur dalam sistem periodik Mendeleev
sesuai dengan kenaikan nomor atomnya. Penempatan telurium (Ar =
128) dan iodin (Ar = 127) yang tidak sesuai dengan keniakan massa
atom relatif, ternyata sesuai dengan kenaikan nomor atomnya (nomor atom Te =
52; I = 53).
2. Sistem Periodik Modern
Sistem periodik modern disusun berdasarkan hukum
periodik modern yang menyatakan bahwa sifat-sifat unsur merupakan fungsi
periodik dari nomor atomya. Artinya, jika unsur-unsur disusun berdasarkan
kenaikan nomor atomnya, maka sifat-sifat tertentu akan berulang secara
periodik. Itu sebabnya tabel unsur-unsur tersebut dinamai Tabel
Periodik.
a. Periode
Lajur-lajur horizontal dalam sistem periodik
disebut periode. Sistem periodik modern terdiri atas 7 periode.
Jumlah unsur pada setiap periode sebagai berikut.
|
Periode
|
Jumlah Unsur
|
Nomor Atom
|
|
1
|
2
|
1-2
|
|
2
|
8
|
3-10
|
|
3
|
8
|
11-18
|
|
4
|
18
|
19-36
|
|
5
|
18
|
37-54
|
|
6
|
32
|
55-86
|
|
7
|
32
|
87-118
|
Periode 1, 2,3 disebut periode pendek karena berisi relatif sedikit unsur, sedangkan periode 4 dan seterusnya disebut periode panjang.
b. Golongan
Kolom-kolom vertikal dalam sistem periodik disebut
golongan. Penempatan unsur dalam golongan berdasarkan kemiripan sifat. Sistem
periodik modern terdiri atas 18 kolom vertikal. Ada dua cara penamaan golongan,
yaitu:
·
Sistem 8
golongan. Menurut cara ini, sistem periodik dibagi menjadi 8 golongan yang
masing-masing terdiri atas golongan utama (golongan A) dan golongan tambahan
(golongan B). Unsur-unsur golongan B disebut juga unsur transisi. Nomor
golongan ditulis dengan angka Romawi. Golongan-golongan B terletak antara
golongan IIA dan IIIA. Golongan VIIIB terdiri atas 3 kolom vertikal.
·
Sistem 18
Golongan. Menurut cara ini, sistem periodik dibagi kedalam 18 golongan,
yaitu golongan 1 sampai dengan 18, dimulai dari kolom paling kiri. Unsur-unsur
transisi terletak pada golongan 3-12
Beberapa golongan unsur dalam sistem periodik
mempunyai nama khusus, diantaranya:
·
Golongan
IA : logam
alkali (kecuali hidrogen)
·
Golongan
IIA : logam alkali
tanah
·
Golongan
VIIA : halogen
·
Golongan
VIIIA : gas mulia
c. Unsur transisi
dan transisi dalam
·
Unsur Transisi
Unsur-unsur yang terletak pada golongan-golongan B
disebut unsur transisi atau unsur peralihan. Unsur-unsur tersebut merupakan peralihan
dari golongan IIA ke golongan IIIA, yaitu unsur-unsur yang dialihkan hingga
ditemukan unsur yang mempunyai kemiripan sifat dengan golongan IIIA
·
Unsur transisi dalam
Dua baris unsur yang ditempatkan dibagian bawah Tabel
Periodik disebut unsur transisi dalam, yaitu terdiri dari:
·
Lantanida,
yang beranggotakan nomor atom 57-70 (14 unsur). Ke-14 unsur ini mempunyai sifat
yang mirip dengan lantanium (La), sehingga disebut lantanoid atau lantanida
·
Aktinida,
yang beranggotakan nomor atom 89-102 (14 unsur). Ke-14 unsur ini sangat mirip
dengan aktinium, sehingga disebut aktinoida atau aktinida
Semua unsur transisi dalam sebenarnya menempati
golongan IIIB, yaitu lantanida pada periode keenam dan aktinida pada periode
ketujuh. Jadi, golongan IIIB periode keenam dan periode ke tujuh, masing-masing
berisi 15 unsur.
d. Hubungan Konfigurasi Elektron dengan Sistem Periodik
Hubungan antara letak unsur dalam sistem periodik
dengan konfigurasi elektronnya dapat disimpulkan sebagai berikut.
·
Nomor
periode sama dengan jumlah kulit
·
Nomor
golongan sama dengan elektron valensi
Berdasarkan hubungan tersebut, maka letak unsur dalam
sistem periodik dapat ditentukan berdasarkan konfigurasi elektron.
e. Sifat-sifat Periodik Unsur
Sifat periodik adalah sifat yang berubah secara
beraturan sesuai dengan kenaikan nomor atom, yaitu dari kiri ke kanan dalam
satu periode, atau dari atas ke bawah dalam satu golongan.
f. Jari-jari Atom
Jari-jari atom adalah jarak dari inti hingga kulit
elektron terluar. Besar kecilnya jari-jari atom terutama ditentukan oleh dua
faktor, yaitu jumlah kulit dan muatan inti.
· Untuk unsur-unsur segolongan, semakin banyak kulit
atom, semakin besar jari-jarinya.
·
Untuk
unsur-unsur seperiode, semakin besar muatan inti, maka semakin kuat gaya tarik
inti terhadap elektron, sehingga semakin kecil jari-jarinya
g. Energi Ionisasi
Energi Ionisasi adalah energi yang diperlukan untuk
melepaskan elektron yang terikat paling lemah oleh suatu atom atau ion dalam
wujud gas.
Hubungan energi ionisasi
dengan nomor atom:
·
dalam
satu golongan, dari atas ke bawah, energi ionisasi semakin kecil.
·
dalam
satu periode, dari kiri ke kanan, energi ionisasi cenderung bertambah.
Besar kecilnya energi ionisasi bergantung pada
besar gaya tarik inti terhadap elektron kulit terluar, yaitu elektron yang akan
dilepaskan. Semakin kuat gaya tarik inti, semakin besar energi ionisasi.
·
dalam
satu golongan, dari atas ke bawah, jari-jari atom bertambah besar, sehingga
gaya tarik inti terhadap elektron terluar semakin lemah. Oleh karena itu,
energi ionisasi berkurang.
·
dalam
satu periode, dari kiri ke kanan, jari-jari atom berkurang, sehingga gaya tarik
inti terhadap elektron semakin kuat. Oleh karena itu energi ionisasi bertambah.
h. Afinitas Elektron
Afinitas elektron adalah besarnya energi yang
dihasilkan atau dilepaskan apabila suatu atom menarik sebuah elektron
·
Dalam
satu golongan dari atas ke bawah, afinitas elektron cenderung berkurang
·
Dalam
satu periode dari kiri ke kanan, afinitas elektron cenderung bertambah
·
Kecuali
unsur alkali tanah dan gas mulia, semua unsur golongan utama mempunyai afinitas
elektronn bertanda negatif. Afinitas elektron terbesar dimiliki oleh golongan
halogen
i. Keelektronegatifan
Keelektronegatifan adalah kecenderungan suatu atom
dalam menarik pasangan elektron yang digunakan bersama dalam membentuk ikatan.
Unsur yang mempunyai energi ionisasi dan afinitas
elektron yang besar tentu akan mempunyai keelektronegatifan yang besar pula.
j. Sifat
Logam dan Nonlogam
Sifat logam bergantung pada energi ionisasi. Semakin
besar energi ionisasi, semakin sukar bagi atom untuk melepas elektron, dan
semakin berkurang sifat logamnya.
k. Kereaktifan
Kereaktifan suatu unsur begantung pada
kecenderungannya melepas atau menarik elektron. Dari kiri ke kanan dalam satu
periode, mula-mula kereaktifan menurun kemudian bertambah hingga golongan VIIA.
Susunan Atom
Atom
adalah bagian terkecil dari suatu unsur yang masih mempunyai sifat-sifat unsur
itu. Atom terdiri atas proton dan neutron. Dalam kaitan dengan susunan atom,
perlu memahami beberapa istilah, yaitu nomor atom, nomor massa, isotop, isobar,
dan isoton.
- Nomor
Atom
Jumlah proton dalam suatu atom disebut nomor atom atau
nomor proton. Jumlah proton khas bagi setiap unsur. Nomor atom unsur-unsur
dapat dilihat pada tabel sistem periodik. Oleh karena suatu atom bersifat
netral, maka jumlah elektron sama dengan jumlah proton. Jadi, nomor atom juga
menyatakan jumlah elektron dalam suatu atom
Nomor atom = jumlah proton = jumlah elektron
Contoh:
Nomor
atom karbon adalah 6, berarti setiap atomm karbon mempunyai 6 proton dan 6
elektron.
- Nomor
Massa
Proton dan neutron
mempunyai massa yang sama, yaitu masing-masing sekitar 1 sma (massa proton =
1,0073 sma; massa neutron = 1,0087 sma), sedangkan massa sebuah elektron sangat
kecil, yaitu 5,486 x 10-4 sma. Massa sebuah atom hanya
ditentukan oleh massa proton da neutronnya, sedangkan massa elektron dapat
diabaikan. Jumlah proton dengan neutron dalam suatu atom disebut nomor massa.
nomor massa = jumlah proton + jumlah neutron
- Notasi
Susunan Atom
Jumlah proton, elektron, dan neutron dalam suatu atom dinyatakan dengan
lambang (notasi) sebagai berikut.
dimana,
X
= lambang atom (=lambang unsur)
Z
= nomor atom = jumlah proton (p) = jumlah elektron (e)
A
= nomor massa = jumlah proton + jumlah neutron = p+n
Oleh
karena A = p + n, sedangkan p= Z, maka A= Z + n atau n = A – Z. Jadi, jumlah
neutron dalam suatu atom sama dengan selisih nomor massa dengan nomor atomnya.
jumlah
neutron (n) = A — Z
Contoh: menyatakan atom alumunium dengan nomor atom 13 dan
nomor massa 27. Atom ini mempunyai jumlah proton = 13, jumlah elektron = 13,
dan jumlah neutron = 27 – 13 = 14
- Isotop
Atom-atom dari unsur yang sama dapat mempunyai massa
yang berbeda. Fenomena ini disebut isotop. Isotop terjadi karena perbedaan
jumlah neutron dalam inti atom
Contoh:
- Isobar
dan Isoton
a) Isobar
Atom dari unsur yang berbeda (mempunyai nomor atom
berbeda), tetapi mempunyai nomor massa sama disebut isobar. Contoh:
b) Isoton
Atom dari unsur yang berbeda (mempunyai nomor atom
berbeda), tetapi mempunyai jumlah neutron sama disebut isoton. Contoh:
- Susunan
Ion
Suatu atom dapat kehilangan elektron atau mendapat
elektron tambahan. Atom yang kehilangan elektron akan menjadi ion positif,
sedangkan atom yang mendapat tambahan elektron akan menjadi ion negatif.
Massa
Atom Relatif (Ar)
Massa satu atom terlalu kecil untuk digunakan dalam perhitungan, maka massa
aton atau molekul dinyatakan dalam satuan massa atom (sma). Satu sma
didefenisikan sebagai 1/12 kali massa sebuah atom 12C netral.
Massa atom relatif (Ar) merupakan satuan massa terkecil suatu unsur atau
senyawa yang dibandingkan dengan 1/12 massa isotop 12C. Atom C
digunakan sebagai standar pembanding karena hasil perbandingan 1/12 x massa
sebuah atom 12C dengan massa atom lain menghasilkan bilangan
yang medekati bulat
1 sma = 1/12 x massa sebuah atom 12C
= 1,66053886 x 10-27 kg
Massa satu atom C adalah 19,9269 x 10-27 kg, karena 1 sma =
1,66053886 x 10-27 kg maka massa satu atom C adalah 12 sma.
Massa Molekul Relatif (Mr)
Massa molekul relatif adalah massa rata-rata dari molekul. Massa molekul
merupakan jumlah dari massa atom-atom penyusunnya. Dengan demikian massa
molekul relatif dapat diperoleh dari jumlah massa atom relatif unsur-unsur
penyusunnya.
Contoh :
Hitunglah
Mr CaBr2, bila Ar Ca = 40,078 dan Ar Br = 79,904
Penyelesaian
Mr CaBr2 = (1 x Ar Ca )+ (2 x Ar Br) = (1 x 40,078) + (2 x 79,904)
= 40,078 + 159,808 = 199,886
Jadi Mr
CaBr2 = 199,889
Bila Ar H
= 1,008, Ar O = 15,999 dan massa 1 atom 12C = 1,99 x 10-23 g,
Tentukan
massa 200 molekul air!
Penyelesaian
Mr H2O = (2 x Ar H )+ (1 x Ar O) = (2 x 1,008 )+ (1 x 15,999)
= 2,016 + 15,999
= 18,015











Tidak ada komentar:
Posting Komentar