A. Pengertian Ikatan Kimia
Adalah
ikatan yang terjadi antar atom atau antar molekul dengan cara sebagai berikut :
a)
atom yang 1 melepaskan elektron, sedangkan atom
yang lain menerima elektron (serah terima elektron)
b)
penggunaan bersama pasangan elektron yang
berasal dari masing-masing atom yang berikatan
c)
penggunaan bersama pasangan elektron yang
berasal dari salah 1 atom yang berikatan
Gas
mulia berupa unsur monoatomik. Yaitu merupakan atom yang berdiri sendiri.
Pada
tahun 1916 G.N Lewis, Langumir, dan Kossel berusaha menjelaskan hal itu.
Menurut mereka, unsur gas mulia sangat stabil karena keunikan konfigurasi
elektronnya. Selain helium, kulit atom terluar gas mulia memiliki delapan
elektron (oktet). Adapun helium memiliki dua elektron (duplet) di kulit
atomnya. Akrena kestabilannya, konfigurasi elektron gas mulia menjadi rujukan
semua atom untuk mencapai kestabilan. Berdasarkan penjelasan itu, Lewis
mengemukakan gagasan, yaitu konfigurasi elektron dari atom-atom yang berubah
sedemikina rupa sehingga konfigurasi elektronnya menyerupai konfigurasi
elektron gas mulia.
Berikut ini sedikit penjelasan
singkat mengenai ikatan kimia:
1.
Tujuan pembentukan ikatan kimia adalah agar
terjadi pencapaian kestabilan suatu unsur.
2.
Elektron yang berperan pada pembentukan ikatan
kimia adalah elektron valensi dari suatu atom/unsur yang terlibat.
3.
Salah 1 petunjuk dalam pembentukan ikatan kimia
adalah adanya 1 golongan unsur yang stabil yaitu golongan VIIIA atau golongan
18 (gas mulia).
4.
Maka dari itu, dalam pembentukan ikatan kimia;
atom-atom akan membentuk konfigurasi elektron seperti pada unsur gas mulia.
5.
Unsur gas mulia mempunyai elektron valensi
sebanyak 8 (oktet) atau 2 (duplet, yaitu atom Helium).
|
Periode
|
Unsur
|
Nomor Atom
|
K
|
L
|
M
|
N
|
O
|
P
|
|
1
|
He
|
2
|
2
|
|||||
|
2
|
Ne
|
10
|
2
|
8
|
||||
|
3
|
Ar
|
18
|
2
|
8
|
8
|
|||
|
4
|
Kr
|
36
|
2
|
8
|
18
|
8
|
||
|
5
|
Xe
|
54
|
2
|
8
|
18
|
18
|
8
|
|
|
6
|
Rn
|
86
|
2
|
8
|
18
|
32
|
18
|
8
|
6.
Kecenderungan unsur-unsur untuk menjadikan
konfigurasi elektronnya sama seperti gas mulia terdekat dikenal dengan
istilah Aturan Oktet
Lambang
Lewis
Selama
pembentukan ikatan, elektron yang terlibat adalah elektron-elektron yang
terlibat pada kulit terluar (elektron valensi). G.N Lewis telah memperkenalkan
suatu metode yang simpel tetapi dapatdigunakan untuk menjelaskan cara
penyusunan el elektron valensi dalam molekul. Berikut ini adalah penjelasan
singkat tentang lambang Lewis dan metodenya :
·
Lambang Lewis gas mulia menunjukkan 8 elektron
valensi (4 pasang).
·
Lambang Lewis unsur dari golongan lain
menunjukkan adanya elektron tunggal (belum berpasangan).
·
Lambang lewis mengunakan tanda (•) dan tanda
silang (x).
Lewis
menggambarkan suatu unsur terdiri atas lambang kimia dan dikelilingi oleh
sejumlah titik atau silang untuk menggambarkan elektron valensinya.
Berdasarkan
perubahan konfigurasi elektron yang terjadi pada pembentukan ikatan, maka
ikatan kimia dibedakan menjadi 4 yaitu : ikatan ion, ikatan kovalen,
ikatan kovalen koordinat / koordinasi / dativ dan ikatan logam.
B.
Ikatan Ion
1. Pembentukan Ion Positif
Ion
positif terbentuk karen asuatu atom melepaskan suatu elektron. Atom yang
cenderung melepaskan atom adalah atom logam. Oleh karena itu, atom logam
disebut unsur elektropositif. Unsur logam golonga utama cenderung melepaskan
elektron valensinya agar memiliki konfigurasi elektron seperti gas mulia.
2.
Pembentukan Ion Negatif
Atom
yang cenderung menangkap elektron adalah atom nonlogam. Oleh karena itu, unsur
nonlogam juga disebut elektronegatif. Unsur nonlogam golongan utama cederung
menangkap elektron sesuai dengan kekurangannya agar memiliki konfigurasi
seperti gas mulia.
3.
Pembentukan Ikatan Ion
a.
Terjadi jika atom unsur yang memiliki energi
ionisasi kecil/rendah melepaskan elektron valensinya (membentuk kation)
dan atom unsur lain yang mempunyai afinitas elektron besar/tinggimenangkap/menerima
elektron tersebut (membentuk anion).
b.
Kedua ion tersebut kemudian saling berikatan
dengan gaya elektrostatis (sesuai hukum Coulomb).
c.
Unsur yang cenderung melepaskan elektron adalah unsur
logam sedangkan unsur yang cenderung menerima elektron adalah unsur
non logam.
d.
Senyawa yang terbentuk karena ikatan ion
disebut senyawa ion
Senyawa
yang mempunyai ikatan ion antara lain :
a)
Golongan alkali (IA) [kecuali atom H] dengan
golongan halogen (VIIA)
Contoh
: NaF, KI, CsF
b)
Golongan alkali (IA) [kecuali atom H] dengan
golongan oksigen (VIA)
Contoh
: Na2S, Rb2S,Na2O
c)
Golongan alkali tanah (IIA) dengan golongan
oksigen (VIA)
Contoh
: CaO, BaO, MgS
4.
Sifat umum senyawa ionik :
1.
Titik didih dan titik lelehnya tinggi
2.
Keras, tetapi mudah patah
3.
Penghantar panas yang baik
4.
Lelehan maupun larutannya dapat menghantarkan
listrik (elektrolit)
5.
Larut dalam air
6.
Tidak larut dalam pelarut/senyawa organik
(misal : alkohol, eter, benzena)
C.
Ikatan Kovalen
1.
Adalah ikatan yang terjadi karena pemakaian
pasangan elektron secara bersama oleh 2 atom yang berikatan.
2.
Ikatan kovalen terjadi akibat ketidakmampuan salah
1 atom yang akan berikatan untuk melepaskan elektron(terjadi pada
atom-atom non logam).
3.
Ikatan kovalen terbentuk dari atom-atom unsur
yang memiliki afinitas elektron tinggi serta beda
keelektronegatifannya lebih kecil dibandingkan ikatan ion.
4.
Atom non logam cenderung untuk menerima
elektron sehingga jika tiap-tiap atom non logam berikatan maka ikatan yang
terbentuk dapat dilakukan dengan cara mempersekutukan elektronnya dan
akhirnya terbentuk pasangan elektron yang dipakai secara bersama.
5.
Pembentukan ikatan kovalen dengan cara
pemakaian bersama pasangan elektron tersebut harus sesuai dengan konfigurasi
elektron pada unsur gas mulia yaitu 8 elektron (kecuali He berjumlah 2
elektron).
Ada 3 jenis ikatan kovalen :
a) Ikatan Kovalen Tunggal
Ikatan
kovalen tunggal, yaitu ikatan dengan satu pasang elektron punya berbarengan. di
gambarkan dengan tanda satu garis ikatan. perumpamaan : ikatan pada atom H (
non logam ) serta atom Cl ( non logam )
b) Pengertian ikatan kovalen rangkap dua
Ikatan
kovalen rangkap dua, yaitu ikatan dengan dua pasang elektron punya berbarengan.
di gambarkan dengan tanda dua garis ikatan. perumpamaan : ikatan antar atom O (
non logamikatan ini melibatkan dua pasang elektron yang diguanakan dengan
berbarengan. perumpamaan senyawa ikatan kovalen rangkap dua yaitu O2 serta CO2.
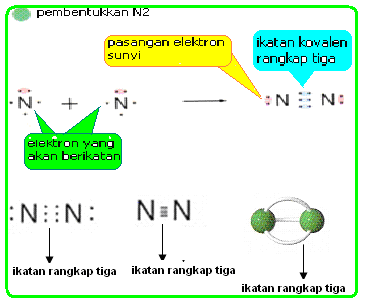
c) Pengertian ikatan kovalen rangkap tiga
Ikatan
kovalen rangkap tiga, yaitu ikatan dengan tiga pasang elektron punya
berbarengan. di gambarkan dengan tanda tiga garis ikatan. perumpamaan : ikatan
antar atom N
d) Sifat-sifat senyawa kovalen sebagai
berikut :
1)
Pada suhu kamar umumnya berupa gas (misal H2,
O2, N2, Cl2, CO2), cair (misalnya: H2O dan HCl), ataupun berupa padatan.
2)
Titik didih dan titik lelehnya rendah, karena
gaya tarik-menarik antarmolekulnya lemah meskipun ikatan antaratomnya kuat.
3)
Larut dalam pelarut nonpolar dan beberapa di
antaranya dapat berinteraksi dengan pelarut polar.
4)
Larutannya dalam air ada yang menghantar arus
listrik (misal HCl) tetapi sebagian besar tidak dapat menghantarkan arus
listrik, baik padatan, leburan, atau larutannya. Anda dapat memprediksi ikatan
kimia apabila mengetahui konfigurasi elektron dari atom unsur tersebut
(elektron valensinya). Dari situ akan diketahui jumlah kekurangan
elektron masing-masing unsur untuk mencapai kaidah oktet dan dupet
(kestabilan struktur seperti struktur elektron gas mulia). Jarak antara dua
inti atom yang berikatan disebut panjang ikatan. Sedangkan energi
yang diperlukan untuk memutuskan ikatan disebut energyikatan. Pada
pasangan unsur yang sama, ikatan tunggal merupakan ikatan yang paling lemah dan
paling panjang. Semakin banyak pasangan electron milik bersama, semakin kuat
ikatan dan panjang ikatannya semakin kecil / pendek .
|
No
|
Sifat
|
Senyawa Ion
|
Senyawa Kovalen
|
|
1
|
Titik didih
|
Tinggi
|
Rendah
|
|
2
|
Titik leleh
|
Tinggi
|
Rendah
|
|
3
|
Wujud
|
Padat pada suhu kamar
|
Padat,cair,gas pada suhu kamar
|
|
4
|
Daya hantar listrik
|
Padat = isolator
Lelehan = konduktor
Larutan = konduktor
|
Padat = isolator
Lelehan = isolator
Larutan = ada yang konduktor
|
|
5
|
Kelarutan dalam air
|
Umumnya larut
|
Umumnya tidak larut
|
|
6
|
Kelarutan dalam trikloroetana (CHCl3)
|
Tidak larut
|
Larut
|
Pengecualian dan Kegagalan Aturan Oktet
1) Pengecualian Aturan Oktet
a)
Senyawa yang tidak mencapai aturan oktet
Meliputi
senyawa kovalen biner sederhana dari Be, B dan Al yaitu atom-atom yang elektron
valensinya kurang dari empat (4).
Contoh
: BeCl2, BCl3 dan AlBr3
b) Senyawa dengan jumlah elektron valensi
ganjil
Contohnya
: NO2 mempunyai jumlah elektron valensi (5 + 6 + 6) = 17
c) Senyawa dengan oktet berkembang
Unsur-unsur
periode 3 atau lebih dapat membentuk senyawa yang melampaui aturan oktet /
lebih dari 8 elektron pada kulit terluar (karena kulit terluarnya M, N dst
dapat menampung 18 elektron atau lebih).
Contohnya
: PCl5, SF6, ClF3, IF7 dan SbCl5
2). Kegagalan
Aturan Oktet
Aturan
oktet gagal meramalkan rumus kimia senyawa dari unsur transisi maupun post
transisi.
Contoh :
a)
atom Sn mempunyai 4 elektron valensi tetapi
senyawanya lebih banyak dengan tingkat oksidasi +2
b)
atom Bi mempunyai 5 elektron valensi tetapi
senyawanya lebih banyak dengan tingkat oksidasi +1 dan +3
Penyimpangan dari Aturan Oktet
dapat berupa :
1) Tidak
mencapai oktet
2) Melampaui
oktet ( oktet berkembang )
Pengertian
ikatan kovalen koordinasi
Ikatan
kovalen koordinasi merupakan sebuah ikatan yang terjadi melalui penggunaan
dalam waktu yang bersamaan pasangan elektron elektron yang berasal dari salah
satu atom yang saling berikatan yaitu pasangan elektron bebas, dimana atom yang
lain hanya menerima pasangan elektron yang digunakan secara bersama-sama.
Pasangan elektron ikatan yang menyatakan ikatan dativ biasanya digambarkan
menggunakan tanda panah dari atom donor ke akseptor pasangan elektron.
Pengertian
ikatan logam
Ikatan
logam merupakan ikatan yang terjadi karena adanya gaya tarik menarik dari
ion-ion logam yang bermuatan positif dengan elektron-elektron bebas yang
bermuatan negatif. Elektron valensin yang terdapat dalam atom logam hanya
berjumlah sedikit sehingga sangat mudah untuk dilepaskan yang kemudian
membentuk ion positif.




Tidak ada komentar:
Posting Komentar